
通过小分子激动剂激活干扰素基因刺激因子(STING)一直被认为是最有前景的免疫疗法策略之一。众所周知,ROS可以通过损伤双链DNA(dsDNA)激活cGAS(环状GMP-AMP合成酶)-STING通路,然而激活cGAS-STING通路的同时,降低该信号轴中关键分子的降解从而达到协同激活的效果却鲜有报道。近日,北京化工大学尹梅贞教授团队和河南大学黄永伟教授团队合作研究开发了一种以苝酰亚胺衍生物为骨架的三合一小分子 STING 激动剂,为肿瘤化疗-免疫疗法提供了一种新的策略,相关研究结果以Sulfonated Perylene as Three-in-One STING Agonist for Cancer Chemo-Immunotherapy为题发表于Angew. Chem. Int. Ed. 2024, DOI: 10.1002/anie.202318799。
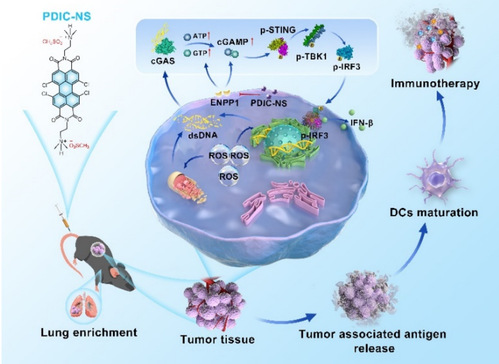
示意图:PDIC-NS诱导的DNA损伤激活cGAS-STING信号通路用于化学-免疫疗法
本研究开发了一种新型苝酰亚胺衍生物PDIC-NS,一方面,它本身的苝酰亚胺骨架可以触发内源性活性氧(ROS)爆发,诱导线粒体DNA(mtDNA)和细胞核DNA(nDNA)损伤,从而有效激活cGAS-STING通路。另一方面,引入的甲基磺酸阴离子则可以较好地抑制ENPP1酶的活性,从而降低其对2’3’-cGAMP的水解。PDIC-NS可以诱导野生型C57BL/6小鼠产生较强的免疫应答,并在STING基因敲除小鼠身上进行了反向验证。总之,本研究提出了一种新的策略,即通过促进内源性环二核苷酸(CDN)即2’3’-cGAMP的产生,同时抑制其水解,从而实现协同激活STING通路的效果。更重要的是,该小分子以肺选择性富集优势避免产生全身免疫毒性。
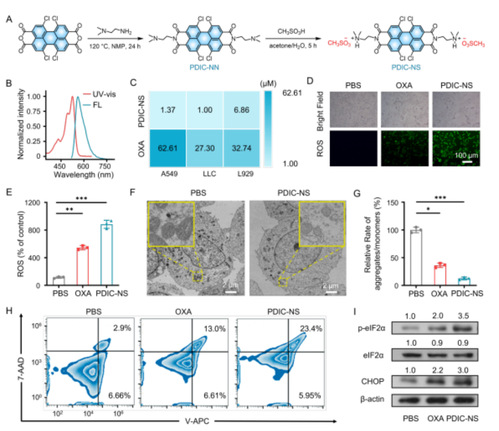
图1:PDIC-NS的合成及生物活性
本研究按照如图1A的步骤成功合成了一种苝酰亚胺衍生物PDIC-NS,通过光学性质验证了其在水溶液中呈典型的单分子状态(图1B)。随后通过MTT实验验证了PDIC-NS对肺相关肿瘤细胞LLC具有更优异的细胞毒性(图1C)。为了进一步探究这种原因,研究人员首先采用倒置荧光显微镜及流式细胞仪检测发现PDIC-NS产生ROS的能力明显优于临床一线药物OXA(图1D, E)。PDIC-NS触发的ROS爆发对线粒体造成了严重的损伤,主要表现为线粒体膜破裂和嵴溶解(图 1F)。随后,JC-1染料的聚集体(红色荧光)和单体(绿色荧光)在LLC细胞中的强度比表明,经PDIC-NS处理的 LLC 细胞膜电位丧失和线粒体严重受损(图 1G)。流式细胞术验证了PDIC-NS 可以触发细胞凋亡(图1H)。过量产生的 ROS也会引发内质网(ER)应激,经验证,C/EBP同源蛋白(CHOP)和磷酸化真核细胞起始因子2α(p-eIF2α)的表达水平均显著上调,这为LLC细胞ER严重氧化应激提供了有力证据。这些发现有力地支持了PDIC-NS能有效引发内源性ROS爆发、线粒体和核损伤,内质网氧化应激,最终导致LLC细胞凋亡的观点。
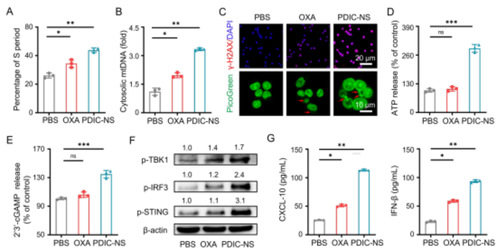
图2. PDIC-NS通过诱导DNA损伤激活cGAS-STING通路
PDIC-NS产生大量的 ROS 会抑制了 DNA 合成,导致S期比例显著增加, 表明DNA受到损伤(图2A)。损伤的dsDNA泄露至胞质中并通过本身的糖-磷酸骨架与 cGAS 中带正电荷的表面之间的多重静电和氢键作用使这些 dsDNA 被识别,然后与 ATP 和 GTP 结合合成 2',3'-cGAMP。随后,cGAMP 与 STING 二聚体结合,从而激活 TANK 结合激酶 1(TBK1)-干扰素调节因子 3(IRF3)轴,释放多种免疫因子,如 I 型干扰素(IFN-β)和肿瘤坏死因子 α(TNF-α),这将大大促进树突状细胞(DCs)介导的 T 细胞的浸润,从而触发强有力的抗肿瘤免疫反应(图例1)。根据上述理论,研究人员首先以定量聚合酶链反应(qPCR)分析证实了 PDIC-NS处理后细胞质中mtDNA 的显著增加(图 2B),用γ-H2AX免疫荧光法检测到细胞核内的γ-H2AX阳性病灶水平明显升高,这表明 PDIC-NS 可引发mtDNA及 nDNA 损伤。研究人员使用了 PicoGreen检测到经PDIC-NS 处理后nDNA 在胞质中的积累(红色箭头所示)(图 2C),随后,胞质dsDNA 被 cGAS 识别并导致LLC细胞中ATP 和 2',3'-cGAMP 的产生(图2D、2E)。研究人员进一步用对硝基苯酚比色法验证了甲基磺酸阴离子赋予了PDIC-NS对ENPP1酶较好的抑制活性。对ENPP1的有效抑制可以减少2’3’-cGAMP的水解,增加其在肿瘤细胞中的富集,从而更高效地激活STING通路,显著上调p-STING、p-IRF3 和 p-TBK1 的水平(图 2F)。同时,酶联免疫吸附试验(ELISA)也验证了促炎性IFN-β和C-X-C基序趋化因子10(CXCL-10)的分泌显著增加(图 2G)。这一观察结果表明PDIC-NS 诱导的DNA损伤有效地激活了cGAS-STING 通路,从而促进了干扰素的分泌。总之,这些研究结果表明,PDIC-NS可增强肿瘤细胞的免疫原性,激活强大的先天性免疫反应,为启动体内全身性抗肿瘤免疫奠定了坚实的基础。
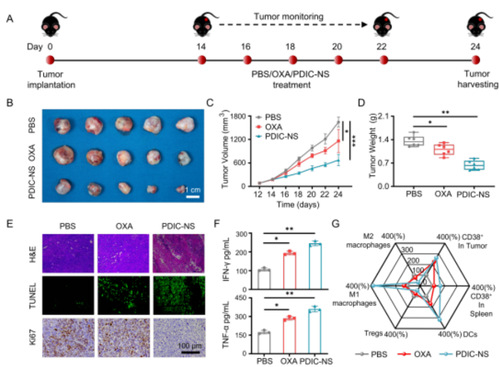
图3. PDIC-NS对皮下异种肿瘤移植模型的抗肿瘤效果
为了评价PDIC-NS的抗肿瘤效果,研究人员首先在 C57BL/6 小鼠右侧皮下建立LLC异种移植肿瘤模型。并以每2天一次,剂量为2 mg kg-1治疗10天(图3A)。治疗结束后,相比于其它组,PDIC-NS 组小鼠的肿瘤体积和重量最小,表明 PDIC-NS 的抗肿瘤效果最好(图 3B-D)。研究人员进一步对肿瘤组织进行了H&E染色、Ki67和TUNEL凋亡检测(图3E)。结果表明,PDIC-NS组肿瘤细胞核明显离解,且具有最低的增殖指数,TUNEL染色表明凋亡参与了PDIC-NS 组肿瘤细胞的清除。这些结果清楚地表明了PDIC-NS 在抑制肿瘤细胞增殖方面的显著疗效。PDIC-NS处理组小鼠血清中的肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)的水平分泌水平最高,表明免疫应答成功激活(图 3F)。随后,研究人员深入研究了肿瘤内T细胞的活化情况,发现PDIC-NS 组处理组小鼠CD3+CD4+ T 细胞,CD3+CD8+ T 细胞和CD3+CD8+CD38+ T 细胞均显著增加,研究人员还检测到脾脏中CD3+CD4+ T 细胞,CD3+CD8+ T 细胞也显著增加(图 3G),这表明小鼠系统性免疫成功应答。综上所述,这些研究结果表明,PDIC-NS 能有效重塑抑制性TME 并引发小鼠的强健免疫反应。
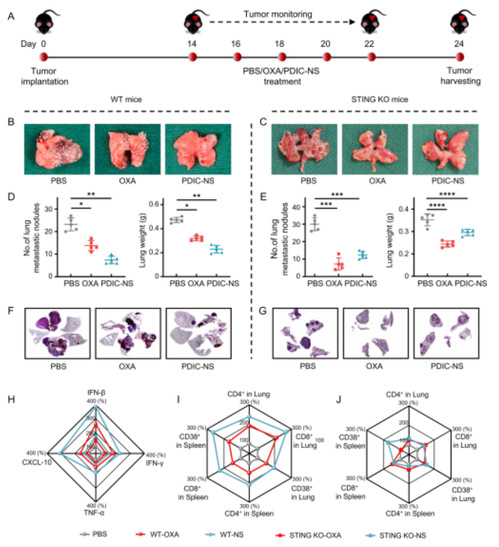
图4. PDIC-NS对肺转移瘤模型的抗肿瘤效果
鉴于 PDIC-NS 在启动抗肿瘤免疫方面的诱人表现,研究人员通过向野生型(WT)和STING 基因敲除型(STING-KO)的 C57BL/6 小鼠建立肺转移模型,并用PDIC-NS(分为WT-NS组和STING-KO-NS组)、OXA(分为WT-OXA组和STING-KO-OXA组)或PBS(分为WT-PBS组和STING-KO-PBS组)处理这些小鼠。经过 10 天的治疗后,分离肺脏以评估 PDIC-NS 的抗肺癌转移效果(图 4A),结果显示,在WT小鼠中,肺转移结节数明显减少,而在STING-KO小鼠中,PDIC-NS的治疗效果大打折扣(图 4B, 4C)。与 WT-PBS 组相比,WT-NS 组的肺转移灶结节显著减少了68.11%。相比之下,STING-KO-NS 组的肺转移灶结节数量比 STING-KO-PBS组仅减少了59%,这一发现凸显了 STING 通路激活在抑制肺转移中的重要作用(图 4D, 4E)。WT-PBS 组和 STING-KO-PBS 组的肺部组织H&E切片表明 PDIC-NS 对 WT 小鼠的抗肿瘤效果更佳,而在 STING-KO 小鼠中的抗肿瘤能力大大减弱(图 4F、4G)。在WT型小鼠中,PDIC-NS 治疗组对 IFN-β 和 CXCL-10 的促进作用最为显著,IFN-γ和TNF-α的含量也有所增加,然而, STING-KO-NS组小鼠的相关免疫因子的分泌水平均显著下降(图 4H)。在WT小鼠肺转移组织中,WT-NS组CD3+CD4+ T细胞,CD3+CD8+ T 细胞,CD3+CD8+CD38+ T 细胞的比例要明显高于WT-PBS及WT-OXA 组,脾脏中也是如此。然而,与WT-NS组相比,STING-KO-NS组肺转移组织中CD3+CD4+、CD3+CD8+、CD3+CD8+CD38+ T细胞的比例均显著下降,表明STING的敲除可以抑制免疫应答。WT小鼠和STING-KO小鼠的肿瘤抑制状态和免疫反应表明PDIC-NS能有效激活WT小鼠的免疫反应,而不能有效激活STING-KO小鼠的先天性免疫。总之,在 WT 小鼠和 STING-KO 小鼠中进行的肿瘤抑制实验为激活cGAS-STING 通路在肿瘤免疫治疗中的关键作用提供了有力的证据。
【总结与展望】
本研究设计并制备一种苝酰亚胺衍生物PDIC-NS,其作为一种新型的小分子STING激动剂能引发内源性ROS爆发,诱导mtDNA和nDNA损伤,从而促进2', 3'-cGAMP 的产生,修饰的甲基磺酸阴离子能有效抑制2', 3'-cGAMP 酶的水解,实现协同激活cGAS-STING信号通路的效果。更重要的是,PDIC-NS能很好地实现肺选择性富集,避免全身免疫毒性的产生。实验结果表明, PDIC-NS 被证明能激活 cGAS-STING 信号通路,对肿瘤异种移植小鼠、肺转移野生型小鼠均产生显著的抗肿瘤活性。总之,这项研究表明,PDIC-NS 可作为三合一小分子 STING 激动剂,其特点是促进 2’3’-cGAMP 的产生,同时减少其降解,并具有良好的组织特异性,为肿瘤化疗免疫疗法提供了一种创新策略和平台。
文章链接:https://doi.org/10.1002/anie.202318799