
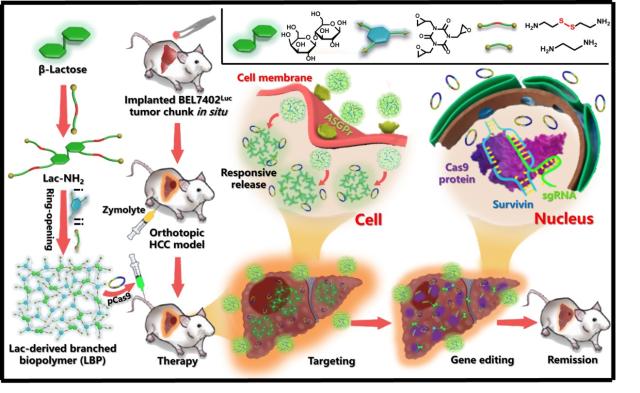
2020年7月21日,北京化工大学材料科学与工程学院徐福建教授(通讯作者)研究团队和山东省肿瘤防治研究院基础研究中心主任杨明教授(通讯作者)研究团队合作,在《Advanced Science》上发表了题为“A Lactose-Derived CRISPR/Cas9 Delivery System for Efficient Genome Editing In Vivo to Treat Orthotopic Hepatocellular Carcinoma”的研究论文。该篇论文提出了一种基于乳糖通过氨基-环氧开环反应构建具有还原响应性的支化阳离子基因载体(LBP)的方法,该阳离子基因载体不仅具有良好的肝靶向性,而且能够有效递送CRISPR/Cas9基因编辑体系,用于体内基因编辑以治疗原位肝癌(HCC)。

基因编辑作为一种新方法在治疗疾病方面显示出巨大的潜力。规律成簇的间隔短回文重复以及其相关蛋白9被称为CRISPR/Cas9系统,最开始作为一种适应性免疫系统在古细菌中被发现。Cas9作为一种核酸酶,可通过短导核糖核酸(sgRNA)的导向,在特定的的基因组位点中产生双链断裂,并且具有较高的编辑效率。尽管CRISPR/Cas9系统具有高度的治疗相关性,但如何安全有效地将CRISPR/Cas9系统递送至靶细胞仍然是需要关注的问题。常见的基因载体分为病毒类和非病毒类载体,病毒类载体免疫原性强,载体容量小,插入突变型强。非病毒类基因载体主要包括脂质体、多肽和阳离子聚合物。其中阳离子聚合物由于其易于制备和修饰的特点受到了越来越广泛的重视,并且考虑到CRISPR/Cas9系统尺寸较大,所以利用阳离子聚合物递送CRISPR/Cas9系统是一种较为合适的方法。另外,乳糖作为一种天然的二糖,包含一个葡萄糖单元和一个半乳糖单元,具有良好的生物相容性。已有研究表明,乳糖具有肝脏靶向性效果。基于上述基础,我们基于乳糖通过氨基-环氧开环反应构建了具有还原响应性的支化阳离子基因载体(LBP)用于递送CRISPR/Cas9基因编辑系统,通过有效的基因编辑来治疗原位肝细胞癌(HCC)。在这项研究中,首先基于乳糖通过氨基-环氧开环反应成功地制备了一种支化阳离子聚合物(LBP),基于材料学和细胞学表征,LBP具有良好的还原响应降解性,生物相容性,转染性能和肝细胞靶向能力。随后,体外与体内抗肿瘤实验共同证明了通过有效的基因编辑,LBP介导的CRIPSR/Cas9系统(LBP/pCas9-survivin)不仅能够有效抑制肝肿瘤(HCC)细胞的增殖,加速细胞凋亡,并且LBP/pCas9-survivin还通过基因编辑增强了抗癌药物的抗肿瘤作用,敏化了药物。该研究为CRISPR/Cas9递送系统的合理设计提供了一种高效而安全的策略。
北京化工大学软物质科学与工程高精尖创新中心的祁宇博士和山东省肿瘤防治研究院基础研究中心的刘艳丽博士为本文的共同一作,徐福建教授和杨明教授为本文的通讯作者,北京化工大学为第一完成单位,山东省肿瘤防治研究院基础研究中心为合作单位。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202001424