
近日,北京化工大学材料学院的徐福建教授/许晨副教授团队在《Nano Today》上发表了题为“Effective prevention of atherosclerosis by non-viral delivery of CRISPR/ Cas9”的研究论文。动脉粥样硬化(AS)是心血管疾病发病率和死亡率高的重要原因之一。前蛋白转化酶枯草杆菌蛋白酶9型(PCSK9)是一种与家族性高胆固醇血症相关的蛋白酶。通过抑制PCSK9可有效降低血浆低密度胆固醇(LDL-C)水平,降低血脂,从而延缓斑块形成。近年来,依托CRISPR/Cas9系统的基因编辑技术显示出巨大的医学潜力,可以永久性地沉默Pcsk9基因以降低胆固醇水平并预防AS。然而,由于存在编辑能力差和基因脱靶问题,将CRISPR/Cas9系统有效地递送到肝脏用于AS的体内基因编辑仍然是一个挑战。
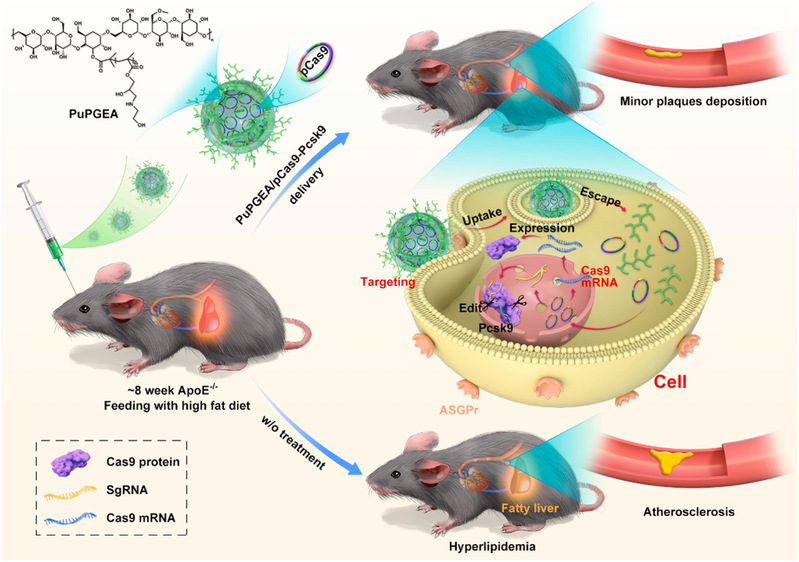
在本研究中,研究人员以普鲁兰多糖为合成骨架,通过原子转移自由基活性聚合(ATRP)和开环反应构建了普鲁兰多糖基的聚甲基丙烯酸缩水甘油酯衍生物(PuPGEA)。该递送载体能够有效的络合高编辑效率的“一体化”工程质粒(pCas9-Pcsk9),实现体内外对于Pcsk9靶点的敲除。实验结果表明,这种阳离子化的CRISPR/Cas9纳米核酸递送系统具有良好的理化性质。同时,载体中大量的羟基赋予了递送系统优异的抗蛋白吸附能力、低溶血效率和高生物安全性。由于普鲁兰多糖能够与肝脏细胞表面过量的去唾液酸糖蛋白受体结合,构建的PuPGEA/pCas9-Pcsk9纳米系统相较于国际金标PEI和非靶向组(无多糖骨架的线性PGEA)具有更好的肝脏细胞结合能力,能够进一步增加编辑效率。体内外实验证明,PuPGEA/pCas9-Pcsk9能够有效地编辑Pcsk9基因,降低PCSK9蛋白的表达,合理控制血浆胆固醇水平,有效抑制动脉斑块的形成。这项工作为动脉硬化斑块和其他血脂异常性疾病提供了一种优秀的治疗策略。此外,这种具有优秀肝脏靶向能力的PuPGEA/CRISPR/Cas9递送系统也可以为各种遗传性肝病的治疗提供参考。
北京化工大学材料科学与工程学院许晨副教授和北京安贞医院心肺疾病研究所张小平博士为本文的共同第一作者。材料科学与工程学院徐福建教授和北京安贞医院心肺疾病研究所李玉琳教授、杜杰教授为本文的通讯作者。北京化工大学为第一完成单位。本研究工作得到了国家重点研发计划、国家自然科学基金和北京高校卓越青年科学家计划的资助。
全文链接:https://www.sciencedirect.com/science/article/pii/S1748013223003468