
北京化工大学的徐福建教授和俞丙然教授团队在《Advanced Materials》杂志(IF = 29.4),在线发表了题为“Controllable Star Cationic Poly(Disulfide)S Achieve Genetically Cascade Catalytic Therapy by Delivering Bifunctional Fusion Plasmids”的研究论文。
该研究以巯基环糊精为引发剂,通过温和可控的双硫交换聚合,构建出高效低毒的可降解阳离子聚合物基因载体β-CD-g-PSS20,β-CD-g-PSS20/pDNA可以通过小窝蛋白介导的内吞进入细胞,实现更高效的转染。利用β-CD-g-PSS20运载融合质粒pCATKR,该递送系统表达融合蛋白CATKR,缩短了CAT和KR催化中心之间的距离,对于乏氧微环境的肿瘤,可以更有效地提高光敏蛋白KR产生活性氧的能力,实现了更加高效的癌症治疗。
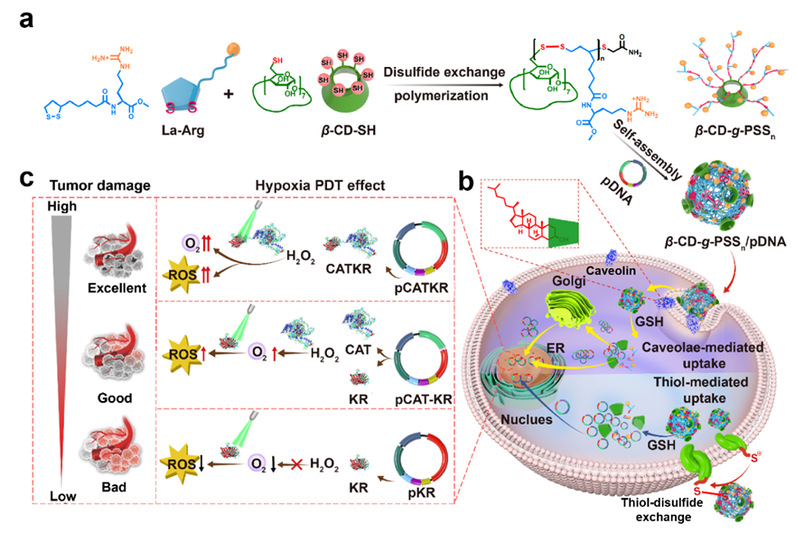
图1. (a) 使用双硫交换聚合合成β-CD-g-PSSn。(b) β-CD-g-PSSn/pDNA通过小窝和硫醇介导的内吞途径被吸收、在细胞中降解、pDNA被释放用于表达。(c) 质粒结构和肿瘤治疗机制。
近些年来,基因治疗在癌症治疗方面受到了越来越广泛的研究。构建安全高效的核酸递送载体并且选择合适的多功能质粒对于基因治疗具有十分重要的意义。传统的阳离子聚合物核酸递送载体主链不可降解并且合成条件复杂,亟需一种温和可控的可降解阳离子聚合物构建策略。
在本研究中,研究人员以巯基环糊精为引发剂,通过温和可控的双硫交换聚合反应,构建出低毒高效的可降解阳离子聚合物基因载体β-CD-g-PSS20,此核酸递送载体在体内外均具有良好的降解能力。由于双硫键以及环糊精的存在,β-CD-g-PSS20/pDNA 复合物可以通过硫醇以及小窝蛋白介导的内吞进入细胞,其中小窝蛋白介导的内吞可以通过高尔基体和内质网将pDNA转运进入细胞核,实现更加高效的转染。
单一功能的质粒很难满足癌症等复杂疾病的治疗,因而多功能质粒在近些年得到了越来越广泛的研究。级联催化反应被称为多米诺骨牌式反应,通过精密的设计引发多步反应。对于级联催化治疗,需要两种或多种治疗剂的共同递送,以充分利用催化反应中间体,达到满意的治疗效果。融合蛋白可以通过连接两种不同的蛋白质,缩短蛋白质之间的距离,以此来增强蛋白质之间的相互作用。因而,将融合蛋白应用于级联催化治疗是非常有前途的创新。但是在体内直接递送蛋白存在困难。因而进一步可以设计融合质粒,使其在体内表达融合蛋白。
在本研究中,β-CD-g-PSS20被用来递送融合质粒pCATKR(表达具有过氧化氢酶CAT和光敏蛋白KR功能的蛋白)来验证融合质粒在级联催化治疗的效果。首先,β-CD-g-PSS20/pCAT-KR (非融合质粒pCAT-KR分别表达CAT和KR)复合物和β-CD-g-PSS20/pCATKR复合物均可以实现分解SCC-7细胞中过氧化氢、改善乏氧微环境的能力,但由于β-CD-g-PSS20/pCATKR复合物表达出的融合蛋白充分缩短了CAT与KR的之间的距离,CAT催化过氧化氢产生的氧气被充分利用,因而β-CD-g-PSS20/pCATKR复合物具有优于β-CD-g-PSS20/pCAT-KR复合物的活性氧产生能力和肿瘤细胞杀伤效果。在SCC-7荷瘤小鼠中,进一步验证了融合质粒对于基因级联催化治疗的效果,通过β-CD-g-PSS20/pCATKR复合物的治疗,肿瘤的体积、重量得到了更加明显的抑制,证明了融合质粒的设计和应用可以改善基因级联催化治疗的效率,产生更多的活性氧,实现更好的治疗效果。
北京化工大学的徐福建教授和俞丙然教授,以及华西医院秦蒙教授为该论文的共同通讯作者,北京化工大学的余丹硕士和硕士生王元琛为本论文的共同第一作者。
全文链接:https://doi.org/10.1002/adma.202307190